Table des matières
Identification de pigments végétaux : activité et situation d'apprentissage
Plant Pigment Identification: A Classroom and Outreach Activity Kathleen C. A. Garber et al J. Chem. Educ., 2013, 90 (6), pp 755–759 DOI: 10.1021/ed200823t résumé de S.P. 2014-2015
Objectif de l'article
Séance de laboratoire sur l'identification de composés chimiques particuliers, les anthocyanines, colorants naturels des plantes.
Rappel sur les anthocyanines
Appelées aussi anthocyanes ou anthocyanosides. Les anthocyanines sont des colorants naturels des feuilles, des pétales et des fruits, situés dans les vacuoles des cellules, allant du rouge orangé au bleu pourpre dans le spectre visible. Elles appartiennent à la famille des flavonoïdes.
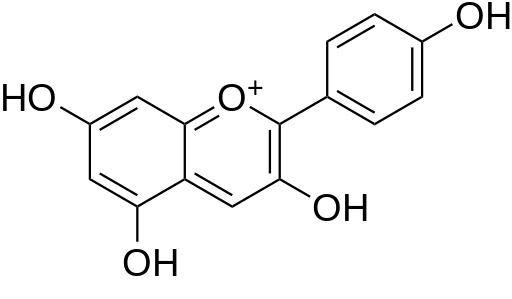
Structure chimique de base commune à toutes les anthocyanines (cation flavylium, cf. ce lien)):
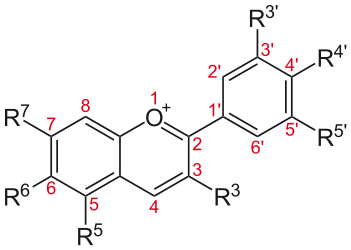 R7, R4' = OH; R3', R5'= H, OH ou OCH3; R5, R3= OH ou O-sucre
R7, R4' = OH; R3', R5'= H, OH ou OCH3; R5, R3= OH ou O-sucre
Sans partie osidique = anthocyanidines (voir plus bas)
Anthocyanines = + 1 partie osidique:
- monosaccharide (glucose, galactose, rhamnose)
- diholoside (rutinose constitué d'un glucose lié à un rhamnose, xyloglucose);
- un triholoside
La plupart des anthocyanines sont des 3-monosides et des 3, 5-diosides d'anthocyanidines. Il existe aussi des diosides liés en 3, 7 et des triosides liés en 3, 5, 3'.
- Exemple: la Pélargonidine, dans fraise, radis rouge, fleurs aux pétales mauves telles que le pélargonium ou le volubilis
- Temps requis : De 30 à 60 minutes, selon le nombre d'échantillons biologiques à analyser (a priori réalisable dans le cadre d'une séance de laboratoire)
- Public cible : “middle school children” = enseignement secondaire inférieur (a priori, DS pas concerné)
- Objectif pédagogique poursuivi : Proposer une activité scientifique attrayante qui s'inscrit dans la volonté de sensibiliser très tôt les jeunes aux sciences
- Matériel nécessaire
- plantes: fleurs, fruits et légumes variés tels que radis, canneberge, rose, mûre, raisin, chou rouge
- pigments de référence ! forme aglycone = anthocyanidines pour des questions de coût et/ou de disponibilité dans le commerce
- petits tubes en plastique (5 par échantillon biologique à analyser)
- pipette
- eau
- solution eau/éthanol 1:1 (pour dissolution des pigments de référence + extraits végétaux)
- solution aqueuse d'HCl 1M (pH 0)
- tampon phosphate 0,5 M (pH 7,4)
- solution aqueuse de NaOH 1M (pH 14)
- une petite paire de ciseaux;
- un économe
- 1 appareil photo par groupe ! (instabilité des molécules)
- Principe de la méthode
- Préparation des échantillons de référence à différents pH (*)
- Préparation des échantillons à analyser dans les mêmes conditions (*)
- Comparaison des colorations des solutions obtenues
- Conclusion: identification du pigment présent dans l'échantillon à analyser
(*) Pour chaque échantillon de référence/test, 4 tubes:
- eau
- eau + HCl
- eau + tampon phosphate;
- eau + NaOH
Commentaires
Avantages:
- Interdisciplinarité - chimie/biologie
- Objectif pédagogique intéressant
- Matériel utilisé simple
- Alternative à l'utilisation de solutions d'acide fort et de base forte: solutions courantes disponibles dans le commerce (sodas, …)
- Public DS: préférable à celui ciblé: sécurité, adéquation programmes DS: 5G (cours acides/bases) ou éventuellement 4G dans le cadre de l'introduction aux labos sur les solutions….
Inconvénients:
- Appareil photo à faire apporter par les élèves, ou usage du smartphone (discrimination, réglementation de l'école, sécurité,…)
- Pigments de référence trop onéreux dans le cadre de l'enseignement secondaire en CFWB (après recherche internet)
Conclusion
Intérêt relatif pour l'enseignement secondaire DS en CFWB
Alternatives proposées
Alternative n°1: Activité mettant en évidence les propriétés acido-basiques du jus de chou rouge (voir site de l'académie de Créteil (FR) : http://spcfa.ac-creteil.fr/IMG/pdf/1s_3-a_et_b-chou_rouge.pdf)
Alternative n°2: Activité mettant en évidence les propriétés acido-basiques du jus de chou rouge, avec autres produits de la vie courante: cf. dossier pédagogigue "De la vinaigrette aux produits d'entretien: la chimie au goût mordant!" Nancy Hecq, UMH (voir http://www.enseignement.be/download.php?do_id=1802)