Les acides donnent-ils vraiment un proton ?
- Cf. chemistry.stackexchange : Do acids really donate a proton?
- Question gérée par S.N., étudiant 2019-2020
Développement
(lignes de développement uniquement - ici figurent qques mots clefs et symboles de type (..) pour définir les lignes directrices de l'argumentaire/l'explication)
- Les questions possibles de l'étudiant (Alexandre) seront les suivantes :
- Les acides donnent-ils vraiment un proton?
- Dans un atome, le proton fait partie intégrante du noyau et donc comment un proton peut-il sortir de l'atome (en évitant les électrons qui gravitent) pour finalement pénétrer et se loger dans le noyau de la base?
- Cela semble impossible, mais la théorie de Brønsted – Lowry stipule pourtant que les acides donnent des protons. du coup je suis confus - Monsieur, pourriez-vous m'expliquer ce que l'on entend réellement par les acides qui donnent des protons?
- Les éléments de réponse du professeur seront les suivants :
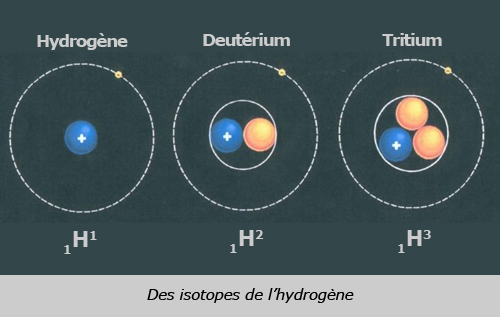
- Tout d'abord, il faut savoir que selon Bronsted et Lowry, un acide est une espèce, ion ou molécule, susceptible de libérer (céder) un ion H+. C'est cet ion H+ qui est nommé proton. Effectivement, H+ est le cation du nucléide 1-1-H (voir première image sur la gauche). Ce cation n'est alors plus qu'un simple proton.
- (..) ta confusion provient peut-être du fait que tu considères un proton quittant un noyau alors qu'en fait il ne fait que quitter une molécule à laquelle il était lié !!!
- (..) Nous ne parlons pas ici de réaction nucléaire où les énergies en jeu seraient bien plus considérables mais bien de réactions acide-base où le transfert du proton H+ résulte de la rupture hétérolytique de la liaison A-H caractéristique d'un acide et de la récupération de ce proton sur un doublet d'électrons non liant d'une base.
- Un acide contient donc nécessairement l'élément hydrogène, mais tout composé hydrogéné n'est pas pour autant un acide (H2 et CH4 n'en sont pas, NaH est basique). Par ailleurs, le caractère acide n'appartient pas seulement aux composés appelés usuellement acides (l'eau, ou le méthanol CH3OH) peuvent se comporter comme des acides).
- Une base est une espèce, ion ou molécule, susceptible de recevoir (fixer) un ion H+ (proton). Une base possède nécessairement un doublet d'électrons non liant, sur lequel l'ion H+ vient se lier par coordinence.
- Debriefing en classe (séminaire de méthodologie)
- Il est important d'écouter, de faire répéter la question de l'étudiant, bref de bien saisir/cerner les difficultés qu'évoque l'étudiant. Ne pas se lancer directement dans une explication sans être sûr d'avoir bien compris comment aider l'étudiant. Le temps est parfois limité, c'est important d'aller à l'essentiel
- Ne pas donner d'éléments n'éclairant en rien l'étudiant. exception faite malgré tout s'il faut donner un peu de contexte.
- Pour l'exercice en classe, il aurait fallu préciser dans quel cadre on donnait la réponse … est-ce un étudiant du 2nd ou 3ème degré, veut-il un rappel complet ou juste une explication sommaire relative à la question stricto sensu ….
- A consulter également : Les acides, les bases et les sels qui nous entourent (notamment concernant l'hydron)