Table des matières
Pourquoi les sels tels que le NaCl se dissolvent dans l'eau ?
- Cf. chemistry.stackexchange : Why do salts such as NaCl dissolve?
- Question gérée par L.G. 2019-2020
Contexte
Début du cours sur la solvatation, 3ème degré du secondaire en sciences générales.
Deux paramètres à prendre en compte :
- Le critère énergétique
- Le désordre
Le critère énergétique
Dans le cas du sel, nous avons affaire à une liaison ionique comme le démontre la différence d'électronégativité importante entre les deux atomes, que vous pouvez consulter dans votre tableau périodique. Ainsi, la liaison ionique repose sur une attraction électrostatique (une charge + et une charge -) entre les deux ions.
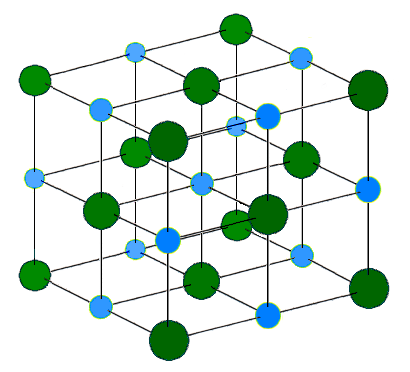
 Ces ions vont interagir entre eux et permettre la création de cristaux ioniques ayant un volume défini.
Ces ions vont interagir entre eux et permettre la création de cristaux ioniques ayant un volume défini.
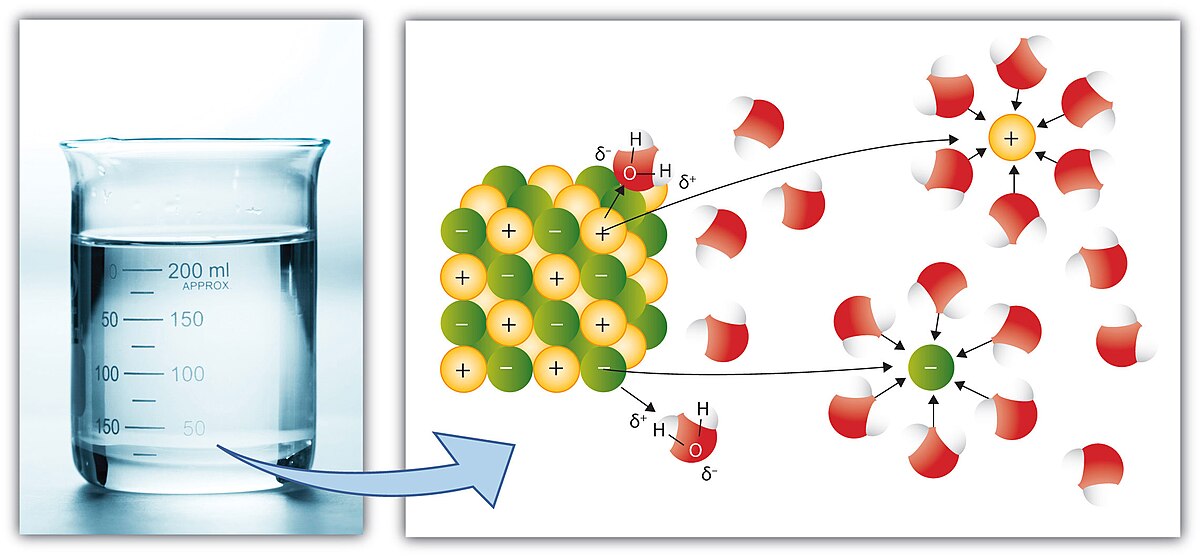
Par la suite, si nous mettons en solution les cristaux NaCl en solution (concrètement, l'eau) nous aurons ce type de comportement :
Nous constatons que les liaisons ioniques entre les anions Cl- et les cations Na+ ne sont plus présentes. Cela est dû à une solvatation des ions par les molécules d'eau. En effet, l'eau étant le solvant, ses molécules se trouvent en bien plus grand nombre dans les conditions utilisées que les ions NaCl.
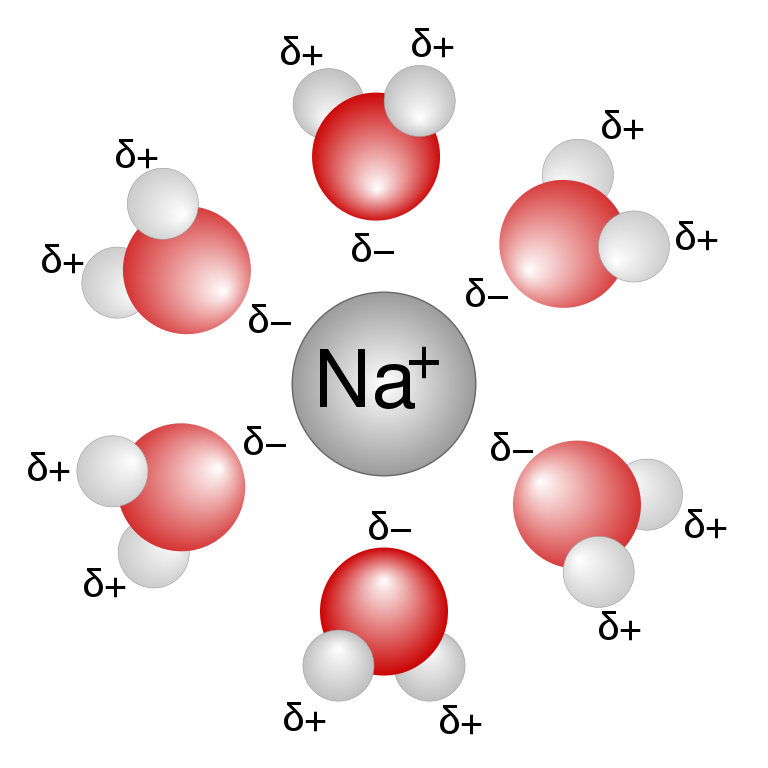
Quelle est la raison de cette solvatation ? Les atomes constituant la molécule d'eau possèdent également une différence d'électronégativité. Ainsi, nous observons une charge partielle positive du côté hydrogéné de la molécule (puisque les hydrogènes sont moins influencés par l'électron de la liaison) et à contrario, une charge partielle négative sera présente du côté de l'oxygène.
Les molécules d'eau vont donc se placer autour des ions de façon à présenter le côté ayant la charge opposée à ce dernier, de manière à stabiliser au mieux le système. Toutefois, puisque il y a perte des liaisons ioniques NaCl, la réaction reste légèrement endothermique.
Le désordre
Puisque les ions Na+ et Cl- passent d'un état cristallin, relativement figé à un état aqueux où le mouvement est constant, l'aspect du désordre est favorable ce qui explique pourquoi la dissolution du sel est facile, même aux conditions CNTP. Explication avec Loi de Le Chatelier, vérifier si désordre vu en classe en tant que tel
Lien avec la vie de tous les jours
Puisque la dissolution du sel dans l'eau est légèrement endothermique, si vous désirez faire des pâtes, il vaut mieux en mettre après ébullition pour ne pas rajouter de temps de cuisson.